È stata svelata per la prima volta la struttura delle fibre di amiloide cardiaca grazie alla collaborazione di ricercatori del Centro per l’Amiloidosi della Fondazione IRCCS Policlinico San Matteo e del Dipartimento di Medicina Molecolare dell’Università di Pavia, guidati da Francesca Lavatelli, Giovanni Palladini e Giampaolo Merlini e i ricercatori del Dipartimento di Bioscienze dell’Università Statale di Milano, guidati da Stefano Ricagno, Carlo Camilloni e Martino Bolognesi. Lo studio riportato da “Nature Communication” (https://rdcu.be/brXkl), rivela la struttura molecolare ad altissima risoluzione delle fibrille amiloidi cardiache, illumina i meccanismi della malattia e fornisce le basi per avanzamenti terapeutici.
Le amiloidosi sono malattie causate da proteine con conformazione anomala che aggregano in fibrille che si depositano in organi vitali danneggiandone la funzione e sono alla base di numerose e gravi patologie, come le malattie di Alzheimer e di Parkinson, e le amiloidosi cardiache.
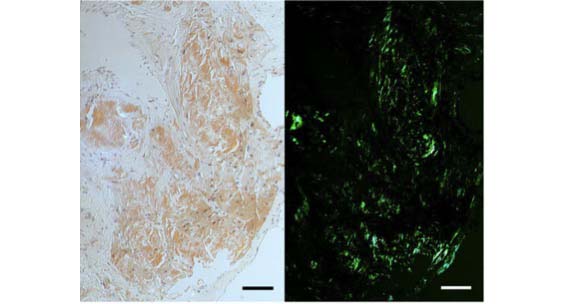
Nel nostro caso, le catene leggere degli anticorpi, prodotte da una popolazione neoplastica di cellule del midollo osseo, formano depositi di amiloide nel cuore danneggiandone rapidamente la funzione (Figura 1*: Immagine di apertura).
Le amiloidosi cardiache sono malattie gravi ed emergenti che necessitano di approcci terapeutici innovativi. I ricercatori del Centro per l’amiloidosi del Policlinico San Matteo sono riusciti a purificare le fibrille di amiloide cardiaca e a caratterizzarle dal punto di vista biochimico. L’analisi ad alta risoluzione è stata condotta nel Laboratorio di Crio-microscopia Elettronica del Centro di Ricerca Pediatrica Romeo ed Enrica Invernizzi presso il Dipartimento di Bioscienze dell’Università degli Studi di Milano, dove dal 2017 è installato un Talos Arctica 200 kV FEG, dotato di direct electron detector Falcon 3EC (ThermoFisher Scientific – FEI). Questa tecnologia sta fornendo risultati senza precedenti nella nostra comprensione della struttura di molecole complesse la cui rilevanza è testimoniata dal Premio Nobel per la Chimica conferito nel 2017.
Lo studio descrive per la prima volta il dettaglio dell’organizzazione tridimensionale di queste fibrille. Ciascuna fibrilla in vivo si estende, con struttura elicoidale e regolare, per qualche decimillesimo di millimetro (Fig.2 A); il dettaglio molecolare che si riesce a raggiungere con il crio-microscopio permette di distinguere gli amminoacidi componenti la proteina fibrillare, raggiungendo quindi una risoluzione prossima al decimilionesimo di millimetro.
Nel caso esaminato, la struttura portante della fibrilla è inaspettatamente costituita da una sola porzione della catena leggera e coinvolge migliaia di copie della stessa che, ripetendosi in maniera ordinata, formano una lunga struttura elicoidale (Fig.2 B). 
Figura 2 A) Alla crio-microcopia elettronica, ciascuna fibrilla (rettangolo rosso tratteggiato) appare come una struttura elicoidale allungata;
Figura 2 B) a 4 Å di risoluzione la struttura ripetitiva della fibrilla appare evidente e permette di interpretare ciascun componente con un modello molecolare della catena leggera immunoglobulinica analizzata (in colore).
La conoscenza della struttura fibrillare suggerisce attraverso quali meccanismi molecolari si formano i depositi patologici.
In prospettiva, la comprensione dei meccanismi di formazione delle fibrille potrà guidare lo sviluppo di nuovi farmaci che prevengano l’aggregazione amiloide.
[*Figura 1. Depositi di amiloide nel cuore colorati con rosso Congo (a sinistra) e osservati in luce polarizzata (a destra) mostrano la tipica birifrangenza verde brillante]