Lunedì 8 ottobre 2018, alle ore 17.00, presso il Collegio Volta di Pavia (Via Ferrata, 17), si terrà il seminario “Targeting diseased epigenomes by tuning mitochondrial metabolism”.
Interviene:
C. Gaetano, Istituti Scientifici Maugeri
La prima parte della presentazione descrive il risultato – pubblicato di recente – di un approccio integrato metabolomico, trascrittomico e genomico, effettuato al fine di comprendere al meglio le alterazioni epigenetiche presenti nelle cellule cardiache stromali primarie dell’uomo, provenienti da pazienti diabetici sottoposti a cardiochirurgia. Questa ricerca, condotta in collaborazione con altri Istituti in Europa, Stati Uniti e Australia, ha portato alla caratterizzazione di nuove cellule di piccole dimensioni coinvolte in specifici processi mitocondriali metabolico-epigenetici che controllano gli enzimi coinvolti nella metilazione del DNA. La seconda parte del seminar consiste nella presentazione di dati non ancora pubblicati riguardanti una nuova funzione del fattore associato P300/CBP (PCAF) nel regolare l’acetilazione dei mitocondri e la loro funzione durante la differenziazione scheletro-muscolare.
Biografia
C Gaetano dirige il laboratorio di Epigenetica di recente fondazione presso gli Istituti Clinici Maugeri a Pavia. Durante gli anni di formazione è stato Fogarty Fellow e socio del National Cancer Institute, sezione genetica molecolare del reparto pediatria dal 1989 al 1992 a Bethesda (USA). E’ stato scienziato visiting presso il National Cancer Institute da maggio 1995 a settembre 1996, ed in seguito professore associato visiting presso la McMaster University, Hamilton (California) nel1999. Dal 1997 al 2012 è stato scienziato senior e group leader presso il laboratorio di Patologia Vascolare dell’Istituto Dermopatico dell’Immacolata-IRCCS. Da maggio 2012 a dicembre 2017 è stato professore di epigenetica delle cellule staminali e direttore del reparto Epigenetica Cardiovascolare presso il Dipartimento di Cardiologia, facoltà di medicina, della Goethe University, Francoforte sul Meno. Il maggiore interesse scientifico di C Gaetano riguarda l’epigenetica applicata a malattie clinicamente rilevanti. Di recente, nel suo laboratorio sono stati creati modelli di patologie umane in vivo e in vitro , con particolare attenzione alle cellule umane primarie isolate provenienti da donatori volontari, incluse cellule staminali di pazienti diabetici e non. I suoi studi riguardano le conseguenze epigenetiche derivanti da fattori ambientali (e.g. elevati livelli di glucosio, raggi UV, sostanze chimiche) che causano alterazioni metaboliche mitocondriali e i loro effetti sulla conformazione, integrità e funzione del DNA. In collaborazione con altri Istituti europei e statunitensi, C Gaetano caratterizza inoltre nuove molecole di piccole dimensioni coinvolte nella metilazione del DNA, tra cui la metiltransferasi DNA (DNMTs) e gli enzimi di traslocazione ten-eleven (TET).
Riferimenti
Oxidative Cytosine Modifications Accumulate in Cardiac Mesenchymal Cells From Type2 Diabetes Patients: Rescue by alpha-Ketoglutarate and TET-TDG Functional Reactivation. Spallotta, F. et al. Stable. Circulation Research 122, 31-46, 2018.
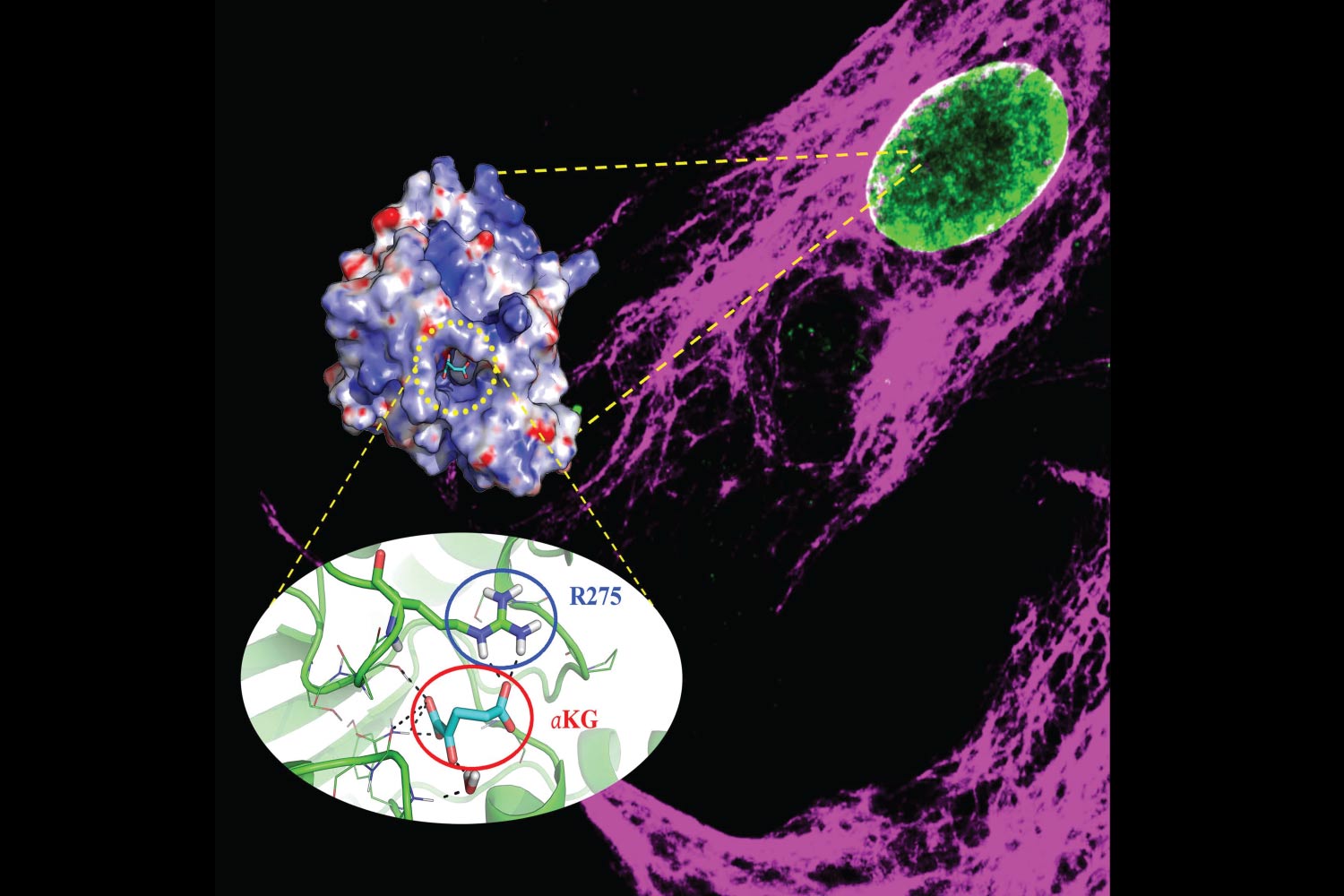
*Immagine: Cellule cardiache mesenchimali affette da diabete e loro nuclei rispettivamente etichettati da vimentina (in viola) e citosina 5-formil (verde). Quest’ultimo si accumula nelle cellule umane cardiache malate. L’inserto mostra l’ α-chetoglutarato (α-KG;segmenti color ciano) che si lega alla timina glicosilasi del DNA (TDG; parte superiore: regioni positive, negative e neutre colorate in blu, rosso e bianco, rispettivamente; parte inferiore: in verde) su Arg275 (R275), che provvede all’ attivazione enzimatica allosterica , facilitando in condizioni normali la demetilazione del DNA. Tale processo è compromesso nelle cellule affette da diabete.
***
English Version:
The first part of the presentation will describe the recently published outcome of an integrated metabolomics, transcriptomic and genomicapproach carried out in order to better understand the origin of epigenetic alteration evident in human primary cardiac stromal cells obtained from diabetic patients undergoing cardiac surgery. This research, conducted in collaboration with other Institutions in Europe, USA, and Australia, led to the characterisation of new small molecules targeting specific mitochondrial metabolic/epigenetic pathways controlling enzymes involved in DNA methylation. The second part of my talk will present unpublished data about a new role for P300/CBP associated factor (PCAF) in regulating mitochondria acetylation and function during skeletal muscle differentiation.
Biography
C Gaetano heads a newly established Laboratory of Epigenetics at Istituti Clinici Scientifici Maugeri in Pavia (Italy). During his training he was Fogarty Fellow and Associate at the National Cancer Institute in the Molecular Genetics Section of the Pediatric Branch from 1989 until 1992, Bethesda (USA). He was a Visiting Scientist of the National Cancer Institute form may 1995 to September 1996 and then Visiting Associate Professor at McMaster University, Hamilton (CA) in 1999. From 1997 to 2012 he was Senior Scientist and Group Leader at the Laboratorio di Patologia Vascolare of the “Istituto Dermopatico dell’Immacolata-IRCCS”. From May 2012 until December 2017 he was Professor of stem cell epigenetics and Director of the Division of Cardiovascular Epigenetics at the Department of Cardiology, Faculty of Medicine, Goethe University, Frankfurt-am-Main (DE). His major scientific interest throughout the years has been epigenetics applied to clinically relevant diseases. In recent years, hid laboratory established in vitro and in vivo human disease models with special attention to human primary cells isolated from volunteer donors including human cardiac stromal cells from non-diabetic and diabetic patients. The studies focused on the epigenetic consequences of environmental challenges (e.g. high glucose, UV radiation, chemicals) causing mitochondrial metabolic alterations and their effect on DNA conformation, integrity and function. Together with other Institutions in Europe and US, he is also characterising new small molecules targeting DNA methylation including DNA methyltransferases (DNMTs) and Ten-eleven-translocation (TET) enzymes.
Reference
Oxidative Cytosine Modifications Accumulate in Cardiac Mesenchymal Cells From Type2 Diabetes Patients: Rescue by alpha-Ketoglutarate and TET-TDG Functional Reactivation. Spallotta, F. et al. Stable. Circulation Research 122, 31-46, 2018.
*Image: Diabetic cardiac mesenchymal cells and their nuclei respectively labelled by vimentin (purple) and 5-formyl cytosine (green). The latter accumulates in diseased human cardiac cells. The inset shows α-ketoglutarate (α-KG;cyan sticks) that binds to thymine DNA glycosylase (TDG; upper part: positive, negative and neutral regions labelled blue, red and white, respectively; lower part: green cartoon) on Arg275 (R275) providing an enzymatic allosteric activation facilitating, in normal conditions, DNA demethylation. This process is impaired in diabetic cells.
In allegato il calendario con gli incontri del mese di ottobre, novembre e dicembre:
Calendario di novembre e dicembre 2018
Per maggiori informazioni: