Lunedi 23 dicembre 2019 è stato pubblicato su Nature Structural & Molecular Biology, una delle riviste scientifiche di maggior prestigio in assoluto, l’articolo “Ancestral-sequence reconstruction unveils the structural basis of function in mammalian FMOs”, relativamente alla scoperta del funzionamento di uno dei sistemi principali per la degradazione di moltissime sostanze tossiche nel nostro organismo. La ricerca è stata svolta principalmente a Pavia, nell’ambito di un progetto Europeo, con un ruolo chiave da parte del dottorando Inglese Callum Nicoll.
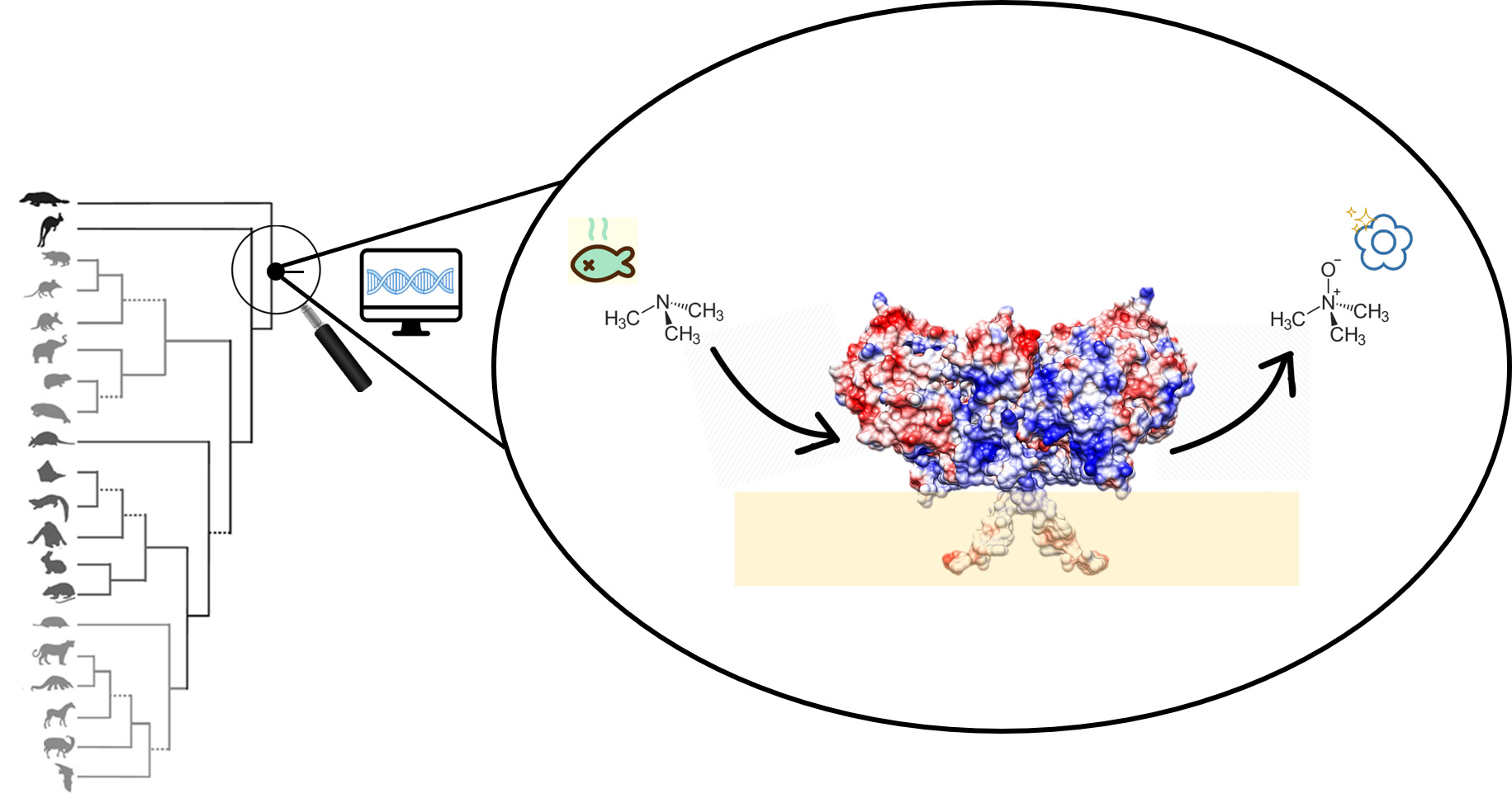
Molti organismi, inclusi gli esseri umani, usano enzimi chiamati FMO per rendere inoffensive le sostanze tossiche. Sebbene siano molto importanti, gli scienziati non conoscevano i dettagli di come funzionano le FMO, perché questi enzimi sono troppo instabili per determinare la loro esatta struttura. Ora, i ricercatori dell’Università di Pavia, insieme a colleghi dei Paesi Bassi e dell’Argentina, hanno trovato un modo per analizzare la struttura di tre enzimi FMO. Si è così scoperto come gli enzimi FMO riescano a sequestrare queste sostanze e modificarle chimicamente, così da inattivarle, facilitando la loro espulsione dal nostro organismo.
Al fine di rendere inoffensive le sostanze tossiche, molti organismi – compresi gli esseri umani – possiedono enzimi chiamati monoossigenasi contenenti flavina (FMO). Le cinque FMO presenti nell’uomo sono coinvolte nel metabolismo di sostanze tossiche e di molti farmaci. Nonostante la loro importanza, la struttura di questi enzimi è rimasta sconosciuta, poiché si tratta di proteine troppo instabili per essere studiate in dettaglio.
“Questi enzimi sono noti da 50 anni, ma non disponevamo ancora di una struttura dettagliata”, afferma Andrea Mattevi che ha coordinato queste ricerche. Le FMO umane sono proteine legate alla membrana e si sono rivelate impossibili da cristallizzare per analisi strutturali standard mediante diffrazione di raggi X. “Il mio gruppo ha pubblicato la struttura di un FMO batterico, circa quindici anni fa, ma questa non era una proteina legata alla membrana.”
Assieme a colleghi Olandesi e Argentini, il gruppo di ricerca di Mattevi ha seguito una strategia del tutto originale per risolvere il problema. I ricercatori hanno pensato di ricostruire l’evoluzione di queste proteine nei mammiferi, generando le FMO “ancestrali”, ossia presenti nell’antenato di tutti i mammiferi. Gli enzimi ancestrali si sono dimostrati sufficientemente stabili da studiare e hanno rivelato in che modo le FMO metabolizzano le sostanze tossiche.
Il team internazionale è infatti riuscito ad analizzare le forme ancestrali di tre dei cinque FMO umani. I colleghi dell’Universidad Nacional de San Luis in Argentina hanno realizzato la ricostruzione, il gruppo dell’Università di Groningen ha prodotto e caratterizzato le proteine, mentre gli scienziati dell’Università di Pavia (Italia) hanno determinato le strutture atomiche.
“I risultati sono affascinanti – afferma Callum Nicoll, un dottorando a Pavia – Molte sostanze tossiche e molti farmaci non gradiscono l’acqua e tendono ad accumularsi nelle membrane cellulari. Gli enzimi FMO possono sequestrare queste sostanze dalle membrane e modificarle chimicamente, così da inattivarle, facilitando la loro espulsione dal nostro corpo. Le FMO hanno strutture leggermente diverse, adatte a diverse classi di composti tossici. Sapevamo che diverse FMO metabolizzano sostanze diverse e ora possiamo spiegare come questo avviene.”
L’approccio con geni ancestrali ricostruiti ha funzionato. “Le proteine ancestrali sono identiche per il 90 per cento alle proteine attuali e la loro funzione è identica”, afferma Mattevi. “Gli scienziati e le aziende farmaceutiche possono finalmente vedere come funzionano gli FMO. E anche l’osservazione che le proteine ancestrali sono più stabili è interessante per progettare enzimi più stabili ad uso industriale. Infine, è ora possibile ricostruire l’effetto delle malattie che causano mutazioni nei geni FMO. Uno di questi provoca la nota sindrome dell’odore di pesce, in cui una mutazione in FMO3 provoca l’incapacità di metabolizzare la sostanza trimetilammina. La trimetilammina, che ha un forte odore di pesce, si accumula nel corpo e viene rilasciata nel sudore, nelle urine e nel respiro. Questo era un progetto ad alto rischio, dato che non sapevamo se la proteina ancestrale sarebbe stata abbastanza stabile. Ma l’idea ha ripagato.”
***
Ancestral-sequence reconstruction unveils the structural basis of function in mammalian FMOs
Nicoll CR, Bailleul G, Fiorentini F, Mascotti ML, Fraaije MW, Mattevi A.
Nature Structural & Molecular Biology23 Dic 2019. doi: 10.1038/s41594-019-0347-2.
https://www.nature.com/articles/s41594-019-0347-2